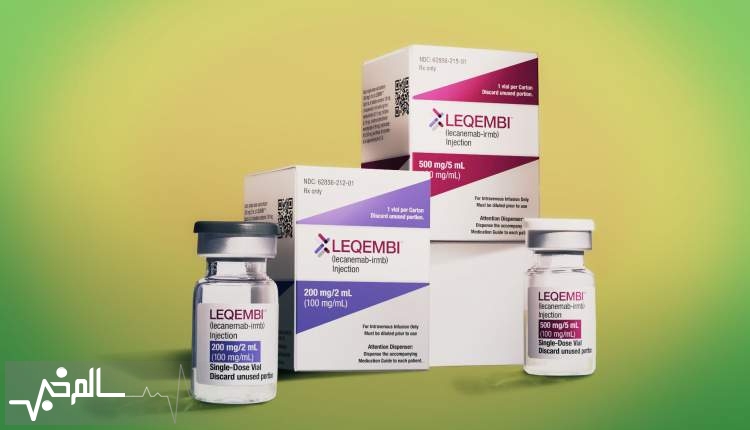
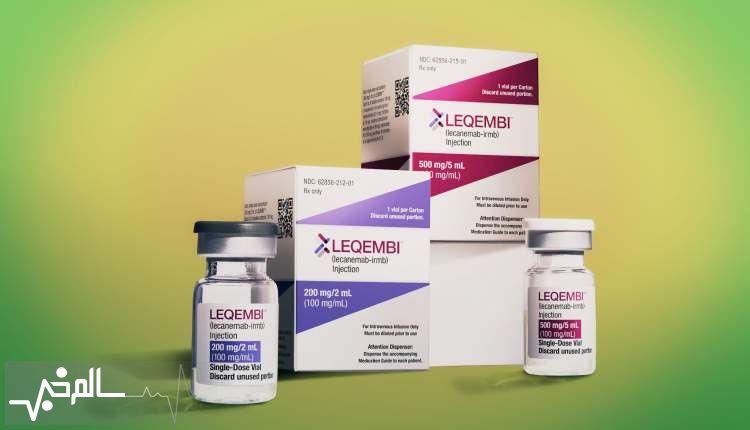
سالمخبر: آژانس دارویی اروپا (EMA) اعلام کرد که دادههای ایمنی جدید مربوط به داروی آلزایمر Leqembi (lecanemab) را بررسی خواهد کرد. این تصمیم پس از تصمیم قبلی برای توصیه استفاده از آن در اتحادیه اروپا اتخاذ شده است.
به گزارش سالمخبر به نقل از medscape، داروی Leqembi برای درمان اختلال شناختی خفیف و بیماری آلزایمر اولیه و بیمارانی که دارای یک یا هیچ نسخه از واریانت ژن آپولیپوپروتئین اپسیلون ۴ (APOE4) هستند، در نظر گرفته شده
است. این آنتیبادی مونوکلونال به اشکال متراکم محلول و نامحلول آمیلوئید بتا متصل میشود و پلاکها را حذف کرده و از تجمع بیشتر آنها جلوگیری میکند.
در نوامبر ۲۰۲۴، کمیته محصولات دارویی انسانی EMA (CHMP) صدور مجوز بازاریابی برای Leqembi را توصیه کرد. این تصمیم، رد اولیه این دارو در جولای ۲۰۲۴ را که در آن کمیته تشخیص داده بود که خطرات دارو بیشتر از مزایای آن است، لغو کرد.
بازبینی مجدد شواهد بالینی، این کمیته را متقاعد
کرد تا تصمیم خود را تغییر دهد. این تجزیه و تحلیل بیماران دارای دو نسخه از ژن APOE4 را حذف کرد و دریافت که مزایای lecanemab در این گروه محدود با مزایایی که در جمعیت گستردهتر مشاهده شد، همسو است.
در نتیجه آن بررسی، صدور مجوز بازاریابی برای بیمارانی که دارای یک یا هیچ نسخه از APOE4 هستند، توصیه شد، مشروط بر اینکه اقدامات کاهش خطر برای کاهش خطر ARIA شدید و علامتدار و نظارت بر عواقب بلندمدت بیماران در نظر گرفته شود.
منبع خبر: سالم خبر / اروپا در تردید تأیید داروی جدید آلزایمر؛ بررسی کامل ایمنی محصول آیزای و بایوجن
گردآوری و انتشار اخبار در این تارنما با هوش مصنوعی و ابزار های الکترونیکی اتوماتیک صورت می پذیرد و تمامی حقوق گردآوری و تالیف خبر متعلق به ناشر اصلی آن که در لینک فوق به آن اشاره شده است می باشد. در صورت نیاز به ارسال جوابیه یا توضیح تکمیلی علیه یا له مطلب منتشر شده صرفا از طریق مرجع اصلی خبر اقدام نمایید.


































نظرات کاربران